(dott. Francesca Grapelli)
Lo studio
È in corso uno studio sulla possibile correlazione tra lo spessore del grasso dorsale (backfat, BF) e del muscolo dorsale (MD) con le performance riproduttive delle scrofe iperprolifiche. Le moderne genetiche hanno un 60% in più di massa muscolare rispetto alle genetiche del passato e, nonostante questa diversità, i parametri che vengono ricercati sono sempre gli stessi: le scrofette vengono selezionate considerando come parametri selettivi il peso, l’età alla pubertà e il BF così come anche le scrofe all’ingresso e all’uscita dalla sala parto sono valutate in termini di BF e peso vivo. Tuttavia, una domanda sorge spontanea: esiste un’implicazione maggiore della componente muscolare nelle prestazioni riproduttive delle scrofe iperprolifiche attuali? Lo studio ha come obiettivo indagare la correlazione tra le performance riproduttive della scrofa e le misurazioni di BF e di MD, al fine di confermare la misurazione dello spessore del grasso dorsale come indicatore predittivo di efficienza riproduttiva o di associarvi, o sostituirvi, la misurazione del muscolo dorsale.
L’indagine si sta conducendo su 2180 scrofe iperprolifiche, primipare e pluripare, allevate in un’azienda della provincia di Brescia, di genetica DanBred, con rimonta interna Topigs; l’allevamento opera in banda trisettimanale, è negativo a PRRS e positivo a Mycoplasma hyopneumoniae e PCV2, ma senza segni clinici. Lo studio è avviato da due anni, durante i quali sono stati raccolti dati riproduttivi (nati vivi, nati morti, mummificati, mortalità in lattazione, peso della nidiata allo svezzamento) e nutrizionali, integrati da misurazioni ecografiche di BF e di MD effettuate all’ingresso e all’uscita dalla sala parto. Le razioni alimentari erano formulate secondo tre fasi di gestazione e una fase di lattazione, con bilanciamento tra energia, proteine e aminoacidi essenziali.
Le razze iperprolifiche
Le scrofette delle case genetiche attuali sono precoci e iperprolifiche: gli studi hanno dimostrato un aumento di 6,7 nati in più nel periodo 2000-2020 (Bortolozzo et al., 2023). Tuttavia, l’estenuante ricerca di linee genetiche sempre più performanti ha condotto a condizioni estreme per cui, la prolificità viene perseguita indipendentemente dal tasso di sopravvivenza della prole durante il parto così come in lattazione. La mortalità al momento del parto e durante le prime fasi di vita del suinetto si aggira tra il 10 e il 20% (S.A. Edwards, 2002, Oliviero et al., 2019) e rappresenta una delle maggiori problematiche nell’industria suinicola attuale (Muns et al., 2015). Inoltre, all’aumento della prolificità non è conseguito un aumento del numero dei capezzoli della scrofa per cui la prole, che già alla nascita si presenta molto più eterogenea in termini di taglia, rispetto al passato, si spareggia ulteriormente una volta conclusa la lattazione. La ridotta taglia dei suinetti corrisponde ad un’immaturità dei sistemi fisiologici, che sommata alla scarsa quantità e qualità del colostro assunta esita in disvitalità e predisposizione allo schiacciamento, precoce esaurimento delle riserve energetiche con conseguente ipotermia e ipoglicemia e morte in breve tempo (Oliviero, 2022). A fronte di ciò, il numero di svezzati/scrofa/anno diminuisce di 1,1-3,1 punti dal numero dei nati vivi (Tummaruk, 2022). La disparità della covata non viene colmata nonostante l’allungamento della lattazione (anche superiore ai 28 giorni) oltre che il supporto integrativo di latte artificiale e mangime sottoscrofa e così i lattonzoli, al momento dello svezzamento, possono avere differenze in peso di oltre 1 kg all’interno della stessa covata.
L’importanza di una corretta alimentazione, in gestazione e in lattazione
Stabilizzata la componente sanitaria, è l’alimentazione della scrofa durante la gestazione e la lattazione a ricoprire un ruolo fondamentale sul metabolismo dell’animale stesso e, di riflesso, anche su quello dei suinetti (Seoane et al., 2020). Malnutrizione e squilibri (obesità o denutrizione) compromettono metabolismo, sviluppo corporeo, pubertà e fertilità. La dieta deve coprire fabbisogni di mantenimento, crescita e gravidanza, con piani nutrizionali specifici fin dalla fase giovanile.
Durante la gestazione, l’alimentazione va modulata:
I fase (1–30 gg)
Si realizza l’impianto degli embrioni, che deve essere sostenuto da un adeguato flushing e il recupero delle riserve corporee, ossia del grasso dorsale, per cui la dieta dovrà fornire tutti gli amminoacidi (digeribili), tra cui la lisina e un buon quantitativo di energia. La dieta poi dev’essere razionata in maniera progressiva facendo attenzione a non eccedere con l’energia nelle prime giornate dopo la fecondazione. Infatti, elevati regimi alimentari nelle prime fasi della gravidanza, favoriscono un incremento della pressione arteriosa che, come conseguenza diretta, favorisce una riduzione della concentrazione plasmatica di progesterone a causa dell’intensa attività di clearance dello stesso da parte del fegato. Si intuisce facilmente come questa situazione possa essere sfavorevole al mantenimento della gravidanza, visto il fondamentale ruolo che il progesterone ha nello sviluppo uterino ed embrionale. Questa attività metabolica sembrerebbe più presente nelle scrofette che non nelle scrofe (Muro et al, 2022-Tavola 1).
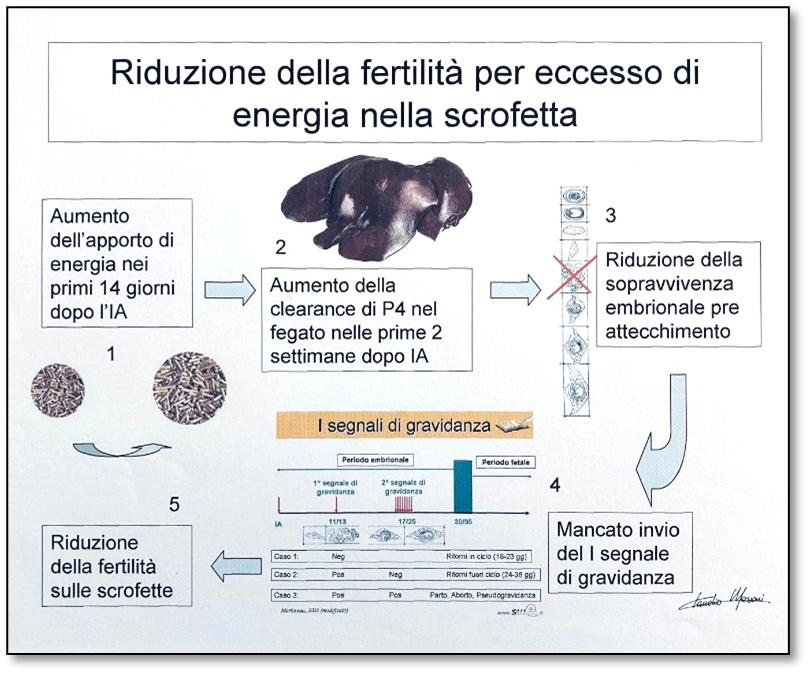
Tavola 1: Riduzione della fertilità e prolificità nelle scrofette a seguito di un eccesso di energia nei primi giorni di gestazione.
II fase (30–80 gg)
Si realizza una trascurabile crescita dei feti e un significativo sviluppo dell’utero e quindi della placenta. In questa fase, può essere utile limitare l’apporto energetico per evitare l’ingrassamento, magari incrementando la fibra per favorire il transito intestinale e la ginnastica funzionale dello stomaco in previsione della lattazione;
III fase (80–114 gg)
La significativa crescita dei feti (35%) e lo sviluppo della mammella richiedono una razione alimentare con un notevole apporto di proteine; il fabbisogno di lisina aumenta di circa il 65% dopo il 90° giorno di gravidanza. Dai 90 giorni di età in poi, Farmer ha chiaramente stabilito che la restrizione alimentare ha effetti negativi sullo sviluppo mammario, un’alimentazione ad libitum può aumentare il peso del parenchima mammario dal 36% al 52% (Farmer, 2017). Un supplemento di grasso aumenta la componente grassa nel latte e ha effetti benefici sulla crescita dei suinetti solo se questi hanno un peso inferiore alla nascita e se la scrofa ha perso molto peso durante la gravidanza (Wang et al., 2022). Un altro studio invece, eseguito su scrofe di genetica DanBred, avrebbe dimostrato che le performance riproduttive di questa genetica non siano influenzate dalla concentrazione energetica della dieta durante la gravidanza, ma piuttosto da un elevato livello di aminoacidi. In questo studio, Seoane e colleghi hanno somministrato dal giorno 77 al giorno 107 di gravidanza 10 g lisina digeribile ileale standardizzata-SID Lys/kg e osservato che, al parto, le dimensioni della figliata e il peso erano maggiori rispetto al gruppo controllo alimentato con i tradizionali 6 g SID Lys/kg.
La restrizione alimentare e la somministrazione unica giornaliera nei giorni immediatamente precedenti al parto porta a ipoglicemia e a una minore disponibilità di energia per le intense contrazioni che l'utero e i muscoli addominali richiedono, che si realizzano attraverso l’ossidazione del glucosio libero nel sangue. A cavallo del parto si consiglia sempre l’inclusione nella razione alimentare di fibra per alleviare il grado di stitichezza (Bortolozzo, 2022).
Durante la lattazione, in tutte le specie, si assiste ad un’importante fase di anabolismo proteico delle proteine del latte (e del colostro) nella ghiandola mammaria, a discapito delle proteine corporee, in particolar modo delle proteine del muscolo scheletrico (actina e miosina). La mobilizzazione proteica è direttamente proporzionale alla dimensione della prole, con i limiti costituzionali genetici che non permettono un soddisfacimento in latte per tutti i 18 e oltre nati vivi. La richiesta massiva in amminoacidi spesso non è supportata da un’alimentazione adeguata, per cui il bilancio nutrizionale giornaliero dell’azoto è negativo. La scrofa sopperisce a questa situazione con il catabolismo proteico muscolare ovvero mobilizza i propri muscoli per ricavare quegli aminoacidi che le servono per la produzione del latte. Questi eventi che di per sé spesso non sono percepibili durante la lattazione (se non con un dimagramento soprattutto nelle primipare), risulteranno fortemente invalidanti per l’avvio della riproduzione nel ciclo successivo allo svezzamento. I processi catabolici proteici, per quanto possano risultare massivi, per meccanismi autoconservativi di specie non possono superare una certa soglia per prevenire un eccessivo deperimento e si arrestano al momento dello svezzamento con la fine della produzione lattea (Clowes J. et al., 2004).
...segue...
BIBLIOGRAFIA
Borges VF, Bernardi ML, Bortolozzo FP, Wentz I. Risk factors for stillbirth and foetal mummification in four Brazilian swine herds. Prev Vet Med. 2005 Sep 12;70(3-4):165-76. doi: 10.1016/j.prevetmed.2005.03.003. Epub 2005 Apr 18. PMID: 16023524.
Bortoletto Giacomo, Le implicazioni nutrizionali della misurazione del grasso e del muscolo dorsali in scrofe e scrofette, Rivista di Suinicoltura, 8, 2023. https://suinicoltura.edagricole.it/alimentazione/misurazione-del-grasso-e-del-muscolo-dorsali-in-scrofe-e-scrofette-implicazioni-nutrizionali/
Bortolozzo FP, Zanin GP, Ulguim RDR, Mellagi APG. Managing Reproduction in Hyperprolific Sow Herds. Animals (Basel). 2023 Jun 1;13(11):1842. doi: 10.3390/ani13111842. PMID: 37889779; PMCID: PMC10252095.
Clowes EJ, Aherne FX, Baracos VE. Skeletal muscle protein mobilization during the progression of lactation. Am J Physiol Endocrinol Metab. 2005 Mar;288(3):E564-72. doi: 10.1152/ajpendo.00198.2004. Epub 2004 Oct 26. PMID: 15507537.
Edwards, Sandra. Perinatal mortality in the pig: Environmental or physiological solutions?. 2002 Livestock Production Science. 78. 3-12. 10.1016/S0301-6226(02)00180-X.
Farmer C, Martineau JP, Méthot S, Bussières D. Comparative study on the relations between backfat thickness in late-pregnant gilts, mammary development and piglet growth. Transl Anim Sci. 2017 Apr 1;1(2):154-159. doi: 10.2527/tas2017.0018. PMID: 32704638; PMCID: PMC7205332.
Hu J, Yan P. Effects of Backfat Thickness on Oxidative Stress and Inflammation of Placenta in Large White Pigs. Vet Sci. 2022 Jun 19;9(6):302. doi: 10.3390/vetsci9060302. PMID: 35737354; PMCID: PMC9230826.
Knecht, Damian & Srodon, Sebastian & Czyż, Katarzyna. Does the Degree of Fatness and Muscularity Determined by Ultrasound Method Affect Sows’ Reproductive Performance?. 2020 Animals. 10. 794. 10.3390/ani10050794.
Lebret A., Teixeira Costa C., Chevance C., Nicolazo T., Berton P., Jeusselin J., Chevance C., Normand V., Brissonnier V., Boulbria M., Impact of backfat thickness on reproductive performances of sows in a farrowing farm background and objectives, 2023 Porc.spetive.
Muns R., Nuntapaitoon M., Tummaruk P., Non-infectious causes of pre-weaning mortality in piglets, Livestock Science, Volume 184,2015, Pages 46-57,ISSN 1871-1413.
Muro BBD, Carnevale RF, Andretta I, Leal DF, Monteiro MS, Poor AP, Almond GW, Garbossa CAP. Effects of uterotonics on farrowing traits and piglet vitality: A systematic review and meta-analysis. Theriogenology. 2021 Feb;161:151-160. doi: 10.1016/j.theriogenology.2020.12.003. Epub 2020 Dec 9. PMID: 33321392.
Oliviero C, Junnikkala S, Peltoniemi O. The challenge of large litters on the immune system of the sow and the piglets. Reprod Domest Anim. 2019 Sep;54 Suppl 3:12-21. doi: 10.1111/rda.13463. PMID: 31512316.
Oliviero C. Offspring of hyper prolific sows: Immunity, birthweight, and heterogeneous litters. Mol Reprod Dev. 2023 Jul;90(7):580-584. doi: 10.1002/mrd.23572. Epub 2022 Apr 22. PMID: 35460115.
Professione suinicoltore, L’alimentazione del suino, Milano, Le Point Vétérinaire Italie srl, 2006.
Roongsitthichai, Atthaporn & Tummaruk, Padet.. Importance of Backfat Thickness to Reproductive Performance in Female Pigs. 2014 The Thai veterinary medicine. 44. 171-178. 10.56808/2985-1130.2557.
Seoane S, De Palo P, Lorenzo JM, Maggiolino A, González P, Pérez-Ciria L, Latorre MA. Effect of Increasing Dietary Aminoacid Concentration in Late Gestation on Body Condition and Reproductive Performance of Hyperprolific Sows. Animals (Basel). 2020 Jan 8;10(1):99. doi: 10.3390/ani10010099. PMID: 31936224; PMCID: PMC7022750.
Thongkhuy, Suphadtra & Chuaychu, SH & Burarnrak, Pitchaya & Ruangjoy, Puritchaya & Juthamanee, Pattawan & Nuntapaitoon, Morakot & Tummaruk, Padet. Effect of backfat thickness during late gestation on farrowing duration, piglet birth weight, colostrum yield, milk yield and reproductive performance of sows. 2020 Livestock Science. 234. 103983. 10.1016/j.livsci.2020.103983.
Tummaruk P, De Rensis F, Kirkwood RN. Managing prolific sows in tropical environments. Mol Reprod Dev. 2023 Jul;90(7):533-545. doi: 10.1002/mrd.23661. Epub 2022 Dec 10. PMID: 36495558.
Tummaruk P, Lundeheim N, Einarsson S, Dalin AM. Factors influencing age at first mating in purebred Swedish Landrace and Swedish Yorkshire gilts. Anim Reprod Sci. 2000 Nov 1;63(3-4):241-53. doi: 10.1016/s0378-4320(00)00184-6. PMID: 10989234.
Wang L, Zhang S, Johnston LJ, Levesque CL, Yin J, Dong B. A systematic review and meta-analysis of dietary fat effects on reproductive performance of sows and growth performance of piglets. J Anim Sci Biotechnol. 2022 Feb 8;13(1):12. doi: 10.1186/s40104-021-00662-3. PMID: 35130973; PMCID: PMC8822652.
Whittemore, C.T., Nutrition reproduction interaction in primiparous sow. 1996 Rev. Livest. Prod. Sci. 46, 65–83.