La farmacovigilanza è l’insieme delle attività di verifica volte a monitorare, valutare, migliorare la sicurezza e l’efficacia del medicinale veterinario, dopo l’autorizzazione all’immissione in commercio, ossia durante l’impiego nella pratica clinica.
La farmaco vigilanza può essere attiva, o passiva. Quella attiva consiste nel monitoraggio intensivo post-marketing per la valutazione del profilo di sicurezza del medicinale nelle sue reali condizioni d’uso. Quella passiva consiste nelle segnalazioni spontanee di reazioni avverse SAR (Suspected Adverse Reaction) o perdita d’efficacia.
Serve, comunque, a verificare l’attendibilità di tutti i risultati ottenuti nelle sperimentazioni fatte dall’ industria farmaceutica. La valutazione riguarda la qualità, l’efficacia e la sicurezza, in riferimento a:
- l’animale trattato;
- il consumatore;
- chi usa il farmaco;
- l’ambiente, ossia piante e animali non sottoposti al trattamento, flora e fauna acquatica.
Posto che nessun medicinale veterinario può essere commercializzato senza A.I.C. da parte del Ministero della Salute o dell’Agenzia Europea per la valutazione dei Medicinali (EMEA), per quanto riguarda, ad esempio, l’efficacia, si tratta di quello che vanta l’industria farmaceutica sull’AIC, ossia sul foglietto illustrativo e che deriva dalla sperimentazione clinica fatta dalla stessa industria farmaceutica. Questo significa che avviene in condizioni ideali per verificare l’efficacia pura del farmaco, cioè in assenza di terapie e patologie concomitanti, su un basso numero di campioni e per un periodo di breve durata. Tali condizioni sono notevolmente diverse da quelle di campo, nell’impiego pratico in cliniche veterinarie, od in allevamenti intensivi. Basta vedere le differenze di impiego di un farmaco prima e dopo l’introduzione sul mercato, relative ad un farmaco umano, ma assolutamente sovrapponibili a quello veterinario (vedere tabella di seguito).

Utilità e qualificazione per il veterinario
Premesso che la farmacovigilanza rappresenta sicuramente un atto qualificante della professionalità del veterinario oltre che atto dovuto per la tutela degli obiettivi di sanità della legge, essa permette al veterinario:
- di avere nel tempo prodotti migliori sul mercato;
- di tutelarsi in caso di effetti dannosi
- di tutelarsi nell’uso in deroga generato dall’inefficacia o dalla minor efficacia di quanto vantato dal farmaco d’elezione.
Ma soprattutto, la farmacovigilanza è un momento altissimo della professione veterinaria. E’ quel momento in cui il veterinario, dopo aver fatto una visita, una diagnosi ed aver deciso una terapia, valuta che i risultati non sono quelli attesi e contribuisce al miglioramento delle terapie possibili “segnalando” il fallimento o il parziale insuccesso di una terapia. E’ anche un momento di qualificazione presso il cliente, quale parte attiva del sistema di controllo della qualità e dell’efficacia del farmaco
Va assolutamente chiarito che non è necessario che il veterinario dimostri una causalità tra la reazione avversa e il farmaco utilizzato.
Infatti, la segnalazione, messa assieme ad altre per quel farmaco, verrà valutata nel suo nesso di causalità da esperti facenti parte della commissione che valuta le segnalazioni. Se il veterinario sbaglia, ed è l’unico a sbagliare, il fatto che ci sia una sola segnalazione non farà “scattare” le misure restrittive.
Quali valutazioni dovrà dare il veterinario:
- SAR attesa coerente con AIC (es. comparsa di sintomi già descritti nell’AIC);
- SAR inattesa non coerente con AIC (es. vomito, diarrea, febbre … in seguito a somministrazione di un farmaco, non descritti nell’AIC);
- SAR grave che provoca morte, pericolo di vita, ospedalizzazione, disabilità, anomalie congenite (es. nascita di vitelli con sindromi emorragiche in seguito alla vaccinazione della madre).
I tempi previsti entro cui fare la segnalazione sono compresi tra 6 giorni (per le SAR gravi) e 15 giorni lavorativi ( per le altre SAR) dall’insorgenza della reazione avversa.
L’oggetto della segnalazione può riguardare:
- Reazioni avverse dell’animale in seguito alla somministrazione del medicinale veterinario;
- Diminuzione d’efficacia;
- Danni ambientali;
- Reazioni avverse nell’uomo che manipola il medicinale.
Nel caso di un uso in deroga, è evidente che se faccio un uso in deroga di un medicinale perché non esiste il farmaco veterinario per la patologia da curare e l’uso in deroga è la prima scelta, una reazione inattesa del farmaco usato in deroga non va a contestare il contenuto del foglietto illustrativo che non prevedeva quell’uso. In questo contesto si può, caso per caso, valutare che valga comunque la pena farla ma non è dovuta. Se invece l’uso in deroga è la seconda scelta perché non ha funzionato il farmaco registrato per quella specie e quella patologia, è sul primo farmaco che devo fare la segnalazione. In questo caso la segnalazione è dovuta, ma è facoltativo dire come si è provveduto per risolvere.
Nel caso dell’uso improprio avendo il veterinario modificato le modalità di utilizzo del farmaco:
- via di somministrazione;
- posologia;
- durata del trattamento;
la segnalazione è dovuta ed è facoltativo dire come si è provveduto per risolvere.
Come fare la segnalazione (click per ingrandire in finestra separata)
Cosa succede alla nostra segnalazione
Alle segnalazioni spontanee di reazioni avverse SAR (Suspected Adverse Reaction) o perdita d’efficacia fatte, nell’ambito della farmacovigilanza, consegue, da parte dei responsabili dei Centri di farmacovigilanza regionali ed al Ministero della Salute, l’analisi e la valutazione. A seguito di tale valutazione delle segnalazioni, si possono determinare:
- Archiviazione della segnalazione
- Eventuali misure restrittive
- Attivazione del Sistema di Allerta rapida
Le misure restrittive possono comprendere:
- Sospensione o revoca dell’autorizzazione all’immissione in commercio.
- Introduzione di avvertenze, reazioni avverse, controindicazioni o limitazione delle indicazioni modifica incidenza.
- Richiesta alle ditte di rapporti di farmacovigilanza più frequenti.
- Richiesta alle ditte di condurre studi di sorveglianza post-marketing.
Conclusioni
Analizzando il trend delle segnalazioni di farmacovigilanza in Italia, si è assistito ad un lento incremento, che ci ha portati dalle 20 segnalazioni del 2001 alle 210 del 2010.
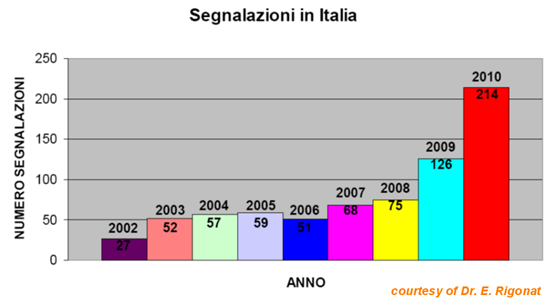
Nel 2011 la Francia, sede del centro europeo di analisi dei dati di farmacovigilanza (Lyon), ha fatto un “Rapporto sulle Segnalazioni di farmacovigilanza” dal 2005 al 2011 (http://agriculture.gouv.fr/IMG/pdf/CGAAER-11041_suivi_post-AMM_Medicaments-veterinaires.pdf).
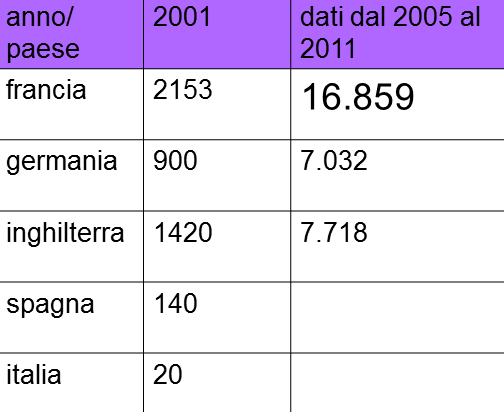
Non bisogna nascondersi che l’Italia rappresenta la “cenerentola” tra i paesi europei più importanti ed a noi vicini dal punto di vista zootecnico, in fatto di segnalazioni di farmacovigilanza.
Appare evidente, infatti, come l’Italia, con le sue poche segnalazioni del 2010, non sia stata presa nemmeno in considerazione, assieme alla Spagna.
Ritengo che una seria riflessione sia doverosa, da parte di una professione intellettuale.
Si ringrazia la Dr.ssa E. Rigonat per la concessione delle slide e delle immagini allegate.