Ascaris suum è un nematode cosmopolita e la sua prevalenza negli allevamenti suini intensivi è forse la maggiore tra gli endoparassiti (Roepstorff et al., 1998; Nansen and Roepstorff, 1999), in grado di causare nel bilancio economico dell’azienda perdite significative (Kipper et al., 2011; Knecht et al., 2011). Tuttavia, a causa della natura per lo più subclinica dell’infestazione, l’ascaridiosi rimane spesso non diagnosticata. La frequente mancanza di dati relativi al proprio stato parassitario rappresenta per l’allevamento un’inconsapevole fonte di mancato guadagno, oltre all’impossibilità di programmazione di un efficace programma di sverminazione.
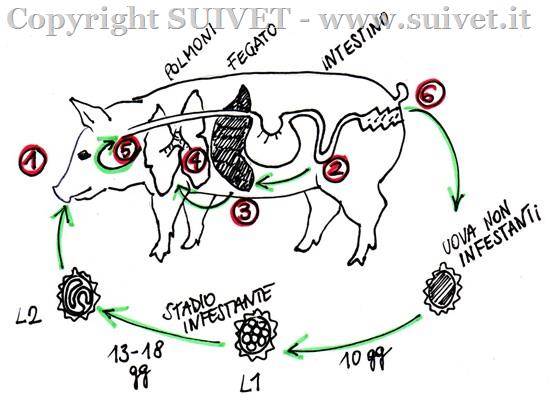
Fig.1 – Ciclo biologico di Ascaris suum. 1) Ingestione; 2) Penetrazione attraverso la parete intestinale; 3) Infestazione del fegato tramite il sistema portale (2-3 giorni dopo l’ingestione); 4) Infestazione del polmone (4-7 giorni dopo l’ingestione); 5) Penetrazione nei bronchioli, espulsione in faringe con colpi di tosse e deglutizione; 6) Espulsione con le feci.
La diagnosi
L’infestazione da A. suum in un dato allevamento può essere diagnosticata con la ricerca delle uova del parassita nelle feci degli animali, con l’individuazione delle classiche lesioni epatiche dovute alla migrazione larvale (white spot), oppure con il ritrovamento dei parassiti adulti nel piccolo intestino dei suini. L’esame coprologico, sebbene sia il metodo diagnostico più facile e rapido, non è rappresentativo del grado di infestazione dell’ospite, né permette di individuare la presenza di uova nelle 6 settimane di prepatenza post-ingestione (Roepstorff et al., 1997; Nejsum et al., 2009). Inoltre, è possibile trovare considerevoli quantità di uova non infestanti a seguito di coprofagia anche in feci di suini non parassitati (Boes et al., 1997). Queste caratteristiche fanno dell’esame coprologico un metodo diagnostico non sempre preciso, ed implicano la necessità di utilizzare un gran numero di campioni fecali per valutare con questo mezzo l’esposizione al parassita di un allevamento.
Il metodo alternativo all’esame coprologico è la punteggiatura epatica al macello, con la quale vengono individuate e classificate le lesioni causate dalla migrazione larvale nell’organo. Tipiche di A. suum sono infatti i cosiddetti white spots o milk spots sulla superficie del fegato (Fig. 2). Questa tecnica diagnostica sembra essere più affidabile dell’esame coprologico, in quanto consente di rilevare lesioni causate dal parassita a partire da 2-3 giorni post-ingestione fino alla loro completa scomparsa almeno un mese dopo il passaggio dell’ultima larva nel fegato.

È doveroso sottolineare tuttavia che nemmeno la punteggiatura epatica al macello rappresenta un metodo diagnostico perfetto. Sembra infatti che la presenza di lesioni epatiche sia strettamente influenzata dalla risposta immunitaria dell’ospite, e che sia maggiormente espressa negli animali che hanno sviluppato elevati livelli di anticorpi nei confronti del parassita (Nejsum et al., 2009; Vlaminck et al., 2011). All’opposto, sembra inoltre che la situazione si inverta nel caso di esposizioni al parassita prolungate, durante le quali è proprio lo sviluppo di immunità a limitare l’arrivo delle larve al fegato e ridurre le conseguenti lesioni (Eriksen et al., 1992; Nejsum et al., 2009). Per questi motivi le ricerche si stanno dirigendo anche verso la messa a punto di metodologie diagnostiche indirette quale il test ELISA, ma attualmente il sistema sembra essere ancora poco agevolmente applicabile in campo e la punteggiatura polmonare sembra il migliore mezzo a disposizione.
Le perdite economiche “invisibili”
Gli endoparassiti rappresentano uno stimolo stressogeno per il metabolismo dell’ospite, alterandone la richiesta nutrizionale e la resa alimentare (Pedersen and Saeed, 2001). Nell’intento di tradurre in numeri le perdite economiche dovute al calo delle performance produttive degli animali, è stata condotta una meta-analisi sulle principali ricerche sull’argomento (Kipper et a., 2011) (Tab. 1). Ne sono emersi due principali aspetti coinvolti nella relazione ospite-parassita:
Influenza del parassita sul metabolismo dell’ospite:
La principale risposta dell’ospite alla presenza del parassita è la riduzione dell’assunzione di alimento (Kyriazakis et al., 1998), stimata del 5%. Questo provoca inevitabilmente una riduzione dell’incremento di peso dell’animale (Hoste, 2001) causata in piccola parte dalla stessa anoressia, ma in misura molto maggiore dalla perdita dell’efficienza nell’assorbimento intestinale dei nutrienti a causa dei danni provocati dalla presenza del parassita. Le lesioni alla mucosa intestinale e l’atrofia dei villi dell’ospite contribuiscono sostanzialmente alla perdita del 31% dell’incremento di peso dell’ospite. Si stima inoltre che queste perdite siano traducibili nell’aumento del 4% della durata della fase di ingrasso. È opportuno sottolineare inoltre che questi dati sono stati ottenuti da studi condotti nel suino leggero, e che quindi sono potenzialmente sottostimati nel caso dell’allevamento del suino pesante.
Tab. 1 – Risultati principali illustrati dalla meta-analisi di Kipper et al. (2011), traducibili in Euro nel calcolo delle perdite economiche di un allevamento infestato da endoparassiti
| |
In presenza di endoparassiti |
| Assunzione di alimento giornaliera |
-5% |
| Incremento di peso giornaliero |
-31% |
| Conversione alimentare |
+17% |
| Durata dell’ingrasso |
+4% |
| Peso finale al macello |
-2,4% |
Stress immunologico.
Le peggiori performance ottenute dai suini parassitati sono probabilmente collegate anche ad un forte stress immunologico. I macrofagi attivati dalla presenza dei parassiti producono citochine pro-infiammatorie che agiscono anche inducendo una serie di risposte metaboliche. A livello di Sistema nervoso centrale, le citochine alterano l’espressione del sistema neuroendocrino riducendo la secrezione dell’ormone della crescita (Johnson, 1997). Per questo motivo i soggetti a lungo immunologicamente stimolati presentano una minore crescita, malgrado sia frequente la completa assenza di sintomatologia clinica (Klasing et al., 1987; Spurlock, 1997). Questo va a sommarsi alla difficoltà di assorbimento dei nutrienti descritta in precedenza, e aumenta drasticamente la capacità di conversione alimentare degli animali parassitati fino al 17% in più rispetto ai sani.
La proteina alimentare e la risposta adattativa dell’ospite
Nella meta-analisi di Kipper et al. (2011), emerge il ruolo ricoperto dalla proteina alimentare nella risposta adattativa dell’ospite parassitato. Viene riportato infatti l’incremento di 1,1 g di incremento giornaliero di peso per ciascun grammo di proteina grezza ingerito con la dieta. In parte, l’importanza dell’apporto proteico per la risposta adattativa dell’ospite è spiegabile con l’aumentata domanda di amminoacidi, necessari sia per la crescita dell’animale che per lo sforzo adattativo del tessuto gastrointestinale che deve far fronte ad un mutato e poco conveniente equilibrio con il parassita che vi alberga. Il metodo suggerito da alcuni autori per tamponare questa deviazione anomala di nutrienti è l’aumento dell’apporto alimentare di specifici amminoacidi, quali la treonina, coinvolta nel miglioramento dell’assorbimento e nel rinnovamento epiteliale a livello intestinale (Stoll et al., 1998). Inoltre, a causa di alterazioni comportamentali e conseguente aumento della richiesta energetica degli animali parassitati, sembra che la correzione alimentare suggerita sia utile anche per soddisfare l’aumentato metabolismo basale che ne consegue (Pedersen et al., 2002; Thomsen et al., 2006). Si sottolinea chiaramente che l’aggiunta di proteina alimentare non deve tuttavia rappresentare la soluzione di un problema parassitario, quanto una condizione momentanea che deve lasciare il posto ad una corretta terapia antiparassitaria.
Qualità della carne al macello
Sebbene le ricerche sulla qualità della carne al macello degli animali con endoparassitosi siano scarse, un recente studio di Knecht et al. (2012) riporta una riduzione della percentuale di muscolo o carnosità (secondo la classificazione EUROP) nelle partite infestate. In aggiunta, Theodoropoulos et al. (2004) osservano nella carne di suini parassitati e macellati a 10 mesi di vita un maggiore tasso di umidità, un minor pH, e colore meno vivo (meno rosso e più giallo).