(dott. Irene Cucco)
Il complesso delle malattie respiratorie del suino (Porcine Respiratory Disease Complex - PRDC) è la principale causa di perdite produttive nell’industria suinicola (Opriessnig et al., 2011). È una patologia multifattoriale determinata dall’interazione di patogeni di origine virale, batterica e, meno frequentemente, parassitaria, e dai fattori ambientali e manageriali (Sarli et al., 2021). Gli agenti patogeni primari sono in grado di causare una sintomatologia grave già di per sé, soprattutto se colpiscono animali sierologicamente negativi. Tuttavia, le infezioni indotte da questi patogeni spesso si risolvono e sono di natura transitoria, a meno che non siano complicate da agenti secondari, che provocano cronicizzazione della patologia e danni economici più seri. Nei patogeni primari sono compresi agenti di natura virale, come il virus della PRRS, i virus influenzali, il coronavirus respiratorio porcino e il PCV2, ma anche alcuni micoplasmi come Mycoplasma hyopneumoniae e batteri, come l’Actinobacillus pleuropnumoniae. La loro azione patogena compromette i meccanismi difensivi dell’apparato respiratorio e promuove l’instaurarsi di infezioni secondarie, spesso da parte di batteri già residenti nelle tonsille e nelle cavità nasali di animali sani. Tra questi troviamo Streptococcus suis, Glaesserella parasuis, Pasteurella multocida, Trueperella pyogenes, Bordetella bronchiseptica, ed Escherichia coli, che possono colonizzare e infettare le vie aeree inferiori (Yaeger e Van Alstine, 2019). In ogni caso, la classificazione dei patogeni è molto labile poiché, soprattutto alcuni microrganismi come Mycoplasma spp., S. suis, P. multocida e A. pleuropnumoniae possono comportarsi sia da agenti primari che secondari, in dipendenza della virulenza del ceppo.
Diagnosi
Diagnosticare quale patogeno sia responsabile della sintomatologia respiratoria riscontrata in campo può essere molto difficile. Infatti, i segni clinici sono in genere molto simili e gli elementi utili per differenziare i diversi patogeni possono essere subdoli, non sempre evidenti, soprattutto in caso di sovrainfezioni batteriche, che spesso mascherano gli effetti delle patologie virali sottostanti (Janke, 1995).
In molti casi, ci vengono in aiuto la valutazione macroscopica e microscopica degli organi. I polmoni dei soggetti sani si presentano collassati, di color rosa salmone uniforme, spugnosi e senza alterazioni di consistenza. Inoltre, la pleura, quella membrana sottile che riveste il polmone, è lucida e trasparente. Microscopicamente, si osserva una trama di tessuto molto labile che costituisce l’interstizio, ovvero quello spazio compreso tra gli pneumociti, cellule molto piatte che rivestono le pareti degli alveoli. Lo spazio interstiziale e gli pneumociti sono così sottili perché devono permettere lo scambio di ossigeno e di anidride carbonica tra il sangue e l’aria contenuta negli alveoli. I bronchioli, invece, veicolano l’aria agli alveoli, e sono rivestiti da cellule cilindriche, dotate di ciglia, che permettono l’allontanamento di polvere e batteri dall’apparato respiratorio.
Nei soggetti affetti da patologie respiratorie, le più comuni forme di polmonite che si possono osservare sono la broncopolmonite catarrale o purulenta, la polmonite interstiziale, la broncopolmonite interstiziale e la pleuropolmonite (Ruggeri et al., 2020).
Broncopolmonite catarrale o purulenta
La broncopolmonite è tipicamente la conseguenza di un’infezione che si instaura per via aerogena, in cui solitamente sono coinvolti virus, M. hyopneumoniae e agenti batterici secondari. I polmoni presentano variazioni di consistenza e di colore che interessano i lobi apicali e ventrali, perché virus e batteri vengono veicolati con la polvere e con le goccioline di aerosol inalate. Al taglio possiamo osservare essudato catarrale denso, ad esempio per il coinvolgimento di M. hyopneumoniae, o pus, per i casi complicati da sovrainfezioni batteriche secondarie.
Microscopicamente, la presenza di edema e macrofagi negli alveoli e nei bronchioli, associati a cellule infiammatorie che circondano, come dei manicotti, anche le pareti dei bronchioli, è fortemente suggestiva di polmonite da M. hyopneumoniae. La presenza di neutrofili e fibrina negli alveoli è indice di complicazioni batteriche secondarie.
Polmonite interstiziale
La polmonite interstiziale, a differenza della broncopolmonite, ha una distribuzione diffusa a tutto il parenchima polmonare e le infezioni batteriche secondarie ai lobi apicali possano mascherarne le lesioni. Questa patologia è solitamente causata da virus, come PRRSV o PCV2, ma può essere anche la conseguenza di una setticemia da batteri Gram negativi. Macroscopicamente, i polmoni sono molto pesanti e di consistenza aumentata; non collassano, e sulla loro superficie rimangono talvolta impressi i segni delle coste. Nella fase acuta dell’infezione le lesioni si presentano più rossastre, e si può osservare edema interstiziale, mentre nelle forme croniche i tessuti colpiti assumono una colorazione più biancastra (Sarli et al., 2021). Istologicamente, è caratteristico l’ispessimento delle pareti alveolari per la presenza di cellule infiammatorie che, necessarie a combattere l’infezione, limitano però gli scambi gassosi. Non è raro riscontrare contemporaneamente PRRSV e PCV2 alla PCR e, in questi casi, l’istologia può aiutare a fare chiarezza sul loro ruolo nell’insorgenza della polmonite. Ad esempio, l’iperplasia degli pneumociti di tipo 2, la necrosi dei macrofagi alveolari e gli aggregati di cromatina libera sono altamente indicativi dell’infezione dal virus della PRRS.
Tipici dell’infezione da PCV2 sono invece i corpi inclusi, costituiti da ammassi di particelle virali situati nel citoplasma dei macrofagi, l’infiammazione granulomatosa, caratterizzata dalla presenza di macrofagi multinucleati e la deplezione linfoide (Caswell e Williams, 2016).
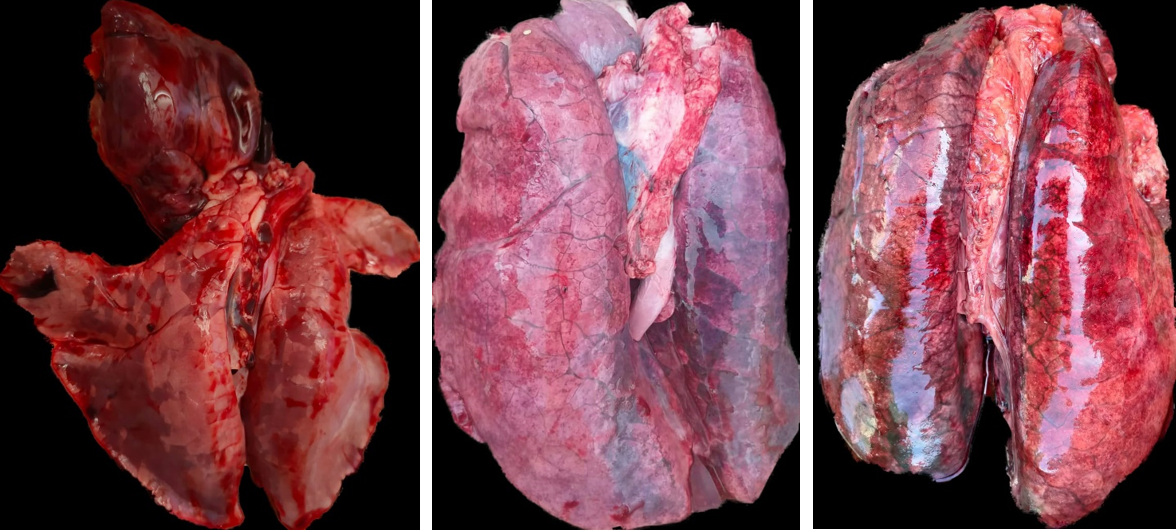
Broncopolmonite interstiziale
Come si può intuire dal termine, nella broncopolmonite interstiziale ritroviamo una sintesi delle caratteristiche principali delle due forme descritte in precedenza, e sia i bronchioli che l’interstizio sono affetti dalla patologia. Nel suino, spesso questa forma è causata dal virus dell’influenza A, nei suoi vari ceppi, che colpiscono i lobi cranioventrali del polmone, dove le lesioni appaiono rossastre, ben demarcate, molto simili a quelle della broncopolmonite. Alla PCR, gli animali potrebbero anche risultare negativi all’influenza, ma a livello istologico, è tipico di questo virus il riscontro di necrosi dell’epitelio alveolare e bronchiolare, con lo sfaldamento delle cellule e la perdita delle ciglia. Si osservano anche infiltrati di cellule infiammatorie nel lume dei bronchioli e nell’interstizio (Caswell e Williams, 2016).
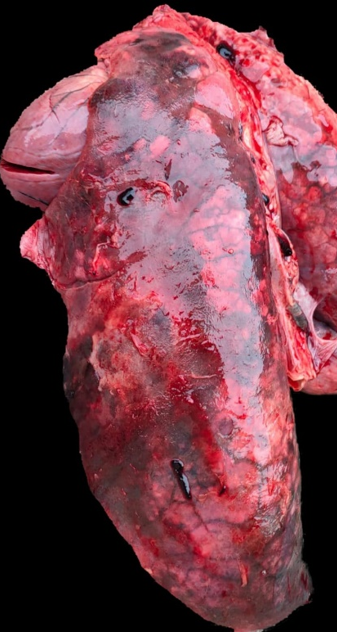
Pleuropolmonite
Con il termine pleuropolmonite si indica una polmonite fibrinosa/necrotizzante/emorragica, associata alla pleurite, che solitamente colpisce le porzioni dorso – caudali del polmone. Nella lesione iperacuta si riscontra un aumento di consistenza delle porzioni affette, di colore rosso – violaceo, associata ad opacamento e ispessimento della pleura. Nelle lesioni acute le aree rossastre sono circondate da striature biancastre, risultanti dalla deposizione di fibrina. Nelle fasi croniche invece, si possono osservare sequestri, ascessi e aderenze tra il parenchima polmonare e la parete toracica (Ruggeri et al., 2020). Al microscopio, negli alveoli e nei bronchioli troviamo fibrina, macrofagi e neutrofili, attivati e degenerati. Sono comuni foci di necrosi a livello dei setti alveolari, trombi e vasculite fibrinosa nei capillari e nelle venule. Quadri indicativi di polmonite fibrinosa e necrotizzante spesso suggeriscono l’infezione da Actinobacillus pleuropneumoniae, ma anche Actinbacillus suis, Salmonella Choleraesuis e alcuni ceppi di Pasteurella multocida possono causare lesioni simili. In questo caso, la diagnosi definitiva dipende dall’isolamento dell’agente patogeno e dall’osservazione istologica di broncopolmonite suppurativa con necrosi neutrofilica (Caswell e Williams, 2016).
Come si può intuire, non è sempre facile diagnosticare un agente patogeno sulla base del solo quadro macroscopico, soprattutto in caso di infezioni batteriche secondarie. L’istologia in questi casi può fornire informazioni importanti e complementari agli esami microbiologici, necessarie per portare a termine un processo diagnostico corretto.
Bibliografia
Caswell J.L., Williams K.J., (2016) Infectious Diseases of Respiratory System. In: Maxie G., Jubb, Kennedy, and Palmer’s pathology of domestic animals, sixth edition, Riverport Lane, St. Louis, Missouri, vol 2, 523 – 536Janke, B. H. (1995). Diagnosis of viral respiratory disease in swine. Swine Health and Production, 3(3), 117.
Opriessnig T., Giménez-Lirola L. G., Halbur P. G. (2011). Polymicrobial respiratory disease in pigs. Animal Health Research Reviews / Conference of Research Workers in Animal Diseases, 12(2), 133–148.
Ruggeri J., Salogni C., Giovannini S., Vitale N., Boniotti M. B., Corradi A., Pozzi P., Pasquali P., e Alborali G. L. (2020). Association Between Infectious Agents and Lesions in Post-Weaned Piglets and Fattening Heavy Pigs With Porcine Respiratory Disease Complex (PRDC). Frontiers in Veterinary Science, 7.
Sarli G., D’annunzio G., Gobbo F., Benazzi C., Ostanello, F. (2021). The role of pathology in the diagnosis of swine respiratory disease. In Veterinary Sciences (Vol. 8, Issue 11). MDPI.
Yaeger J.M., Van Alstine W.G, (2019) Respiratory System. In: Zimmerman J. J, Karriker L. A., Ramirez A., Schwartz K. J., Stevenson G. W., Zhang J., Diseases of Swine, Wiley-Blackwell, Hoboken, NJ, 393-407.