(dott.ssa Irene Cucco)
Immaginiamo per un attimo di metterci nei panni di un batterio allo stato planctonico, ovvero che vive disperso in un ambiente acquoso. Saremmo perfettamente autosufficienti e potremmo crescere e dividerci. Tuttavia, dovremmo continuamente adattarci alle condizioni ambientali a cui siamo sottoposti. Se ci trovassimo su una superficie correremmo il rischio di andare incontro a disidratazione, di essere dilavati o di entrare in contatto con principi attivi disinfettanti. Se stessimo invece colonizzando e infettando un organismo vivente, dovremmo fare i conti con la sua risposta immunitaria o con le sostanze antibiotiche che gli vengono somministrate. Per superare queste difficoltà, i batteri possono passare allo stato sessile e formare il biofilm, struttura complessa dove i microrganismi aderiscono a una superficie, biologica o inerte, e si aggregano gli uni agli altri, anche grazie alla matrice che producono. Inglobate in questa struttura, le cellule batteriche acquisiscono un’elevata resistenza all’ambiente esterno, sfuggendo alla risposta immunitaria e all’azione degli antibiotici e dei disinfettanti.
Sebbene questa strategia sembri concettualmente molto semplice, i meccanismi che stanno alla base della formazione del biofilm sono in realtà molto complessi, nonché straordinariamente efficaci. Il primo step è l’adesione reversibile del batterio alla superficie, che avviene grazie a particolari interazioni chimico – fisiche che si stabiliscono tra la parete batterica e la superficie stessa, facilitate dalla presenza di pili o flagelli, di cui alcuni microrganismi sono dotati.
L’adesione diventa irreversibile nel momento in cui il batterio si stabilizza e inizia a produrre la matrice extracellulare, costituita da esopolisaccaridi, proteine e acidi nucleici. Questo è un passaggio fondamentale perché ciascun componente della matrice svolge un ruolo importante per la sopravvivenza, la maturazione e la dispersione del biofilm stesso. Ad esempio, gli esopolisaccaridi, formati da unità ripetitive di glucidi, vengono prodotti dalle cellule batteriche e secreti all’esterno. Come una rete, uniscono i batteri gli uni agli altri, creando un’impalcatura che protegge le cellule e permette lo scambio di sostanze nutritive e di mediatori chimici. Le proteine invece possono avere una funzione meccanica, stabilizzando l’architettura del biofilm e conferendo resistenza alla struttura, che diventa in grado di sopportare forze anche notevoli. Oppure, altre proteine sono coinvolte nei processi di degradazione della matrice, che può costituire una fonte energetica per le cellule batteriche in caso di carenza di sostanze nutritive. Nella matrice troviamo anche frammenti di DNA extracellulare, che sembrano essere importanti sia nella fase di adesione, sia nello sviluppo dell’antibiotico resistenza.
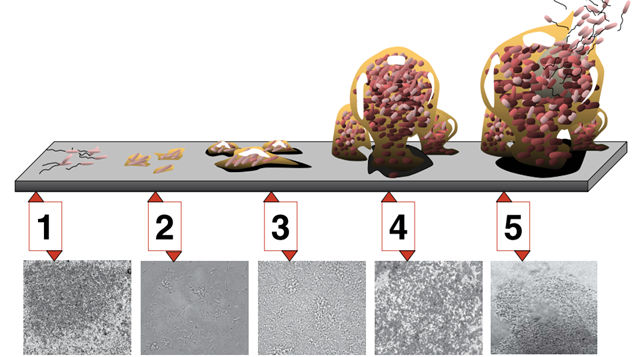
Figura 1 Schema dei diversi stadi di formazione del biofilm e relative immagini al microscopio di biofilm di Pseudomonas aeruginosa (immagini allo stesso ingrandimento). Fase 1: adesione iniziale. Fase 2: adesione irreversibile. Fase 3 e 4: maturazione. Fase 5: dispersione. (Monroe, 2007)
Una volta che il primo strato di biofilm si è formato, nella fase di maturazione vengono inglobate altre cellule batteriche della stessa specie o di specie diversa. A questo punto, l’organizzazione si fa sempre più complessa perché all’interno del biofilm si creano delle sottopopolazioni eterogenee, che mutano sempre di più sia fenotipicamente che genotipicamente, in dipendenza della concentrazione di ossigeno, nutrienti e prodotti di scarto presenti. Ad esempio, negli strati più profondi troveremo quelle specie batteriche che tollerano poco o per nulla l’ossigeno, mentre negli strati più superficiali si svilupperanno batteri che necessitano di ossigeno per sopravvivere.
Infine, diversi fattori tra cui la carenza di nutrienti, l’accumulo di prodotti di scarto, la competizione tra le specie batteriche o l’eccessiva densità della popolazione microbica determinano la dispersione del biofilm stesso. In genere, in questa fase, soltanto una parte dei batteri ritornano allo stato planctonico, per poi andare a colonizzare nuove superfici.
Ma perché il biofilm ci spaventa così tanto? Uno dei principali fattori che rendono i batteri all’interno del biofilm così pericolosi per la salute umana e animale è la loro spiccata tendenza a diventare antibiotico - resistenti. Addirittura, in alcuni studi le cellule nel biofilm sono risultate 10.000 volte più resistenti ad alcuni tipi di antibiotici rispetto ai batteri allo stato planctonico. Si pensa che la matrice giochi un ruolo importante nel limitare la diffusione dei principi attivi nello spessore dei vari strati del biofilm, facendo sì che questi entrino in contatto con i batteri a concentrazioni subottimali. Inoltre, se alcuni batteri possono diventare antibiotico resistenti grazie a mutazioni casuali che avvengono all’interno del proprio genoma, la ridotta motilità e l’elevata densità cellulare dei batteri aggregati nel biofilm favoriscono la trasmissione orizzontale dei geni di resistenza. È anche importante ricordare che la maggior parte dei principi attivi che utilizziamo ha come target cellule in fase attiva di replicazione, mentre nel biofilm i microrganismi spesso rallentano il loro metabolismo e questo fa sì che l’efficacia del trattamento si riduca. Come se non bastasse, sembra che alcune sostanze prodotte nel biofilm siano in grado di alterare i meccanismi dell’immunità innata, attenuandoli.
Purtroppo, secondo il National Institute of Health più dell’80% di tutte le infezioni umane sono correlate al biofilm. Qualche esempio? Uno dei primi biofilm descritti è la placca dentale, uno straordinario aggregato di microrganismi che riesce a persistere nonostante la forza generata durante la masticazione e le variazioni di pH, temperatura e ossigeno che avvengono quotidianamente nel cavo orale. Da questa sede i batteri possono causare gengiviti, ascessi e, attraverso il circolo sanguigno, anche infezioni polmonari o endocarditi. Tra le infezioni più studiate abbiamo anche la polmonite da Pseudomonas aeruginosa nei pazienti affetti da fibrosi cistica, l’otite media cronica da Haemophilus influenzae e Streptococcus pneumoniae e le infezioni ricorrenti da Escherichia coli del tratto genito-urinario (Hall-Stoodley & Stoodley, 2009). Infine, stanno diventando sempre più importanti le infezioni nosocomiali legate all’utilizzo di dispositivi come cateteri, protesi e impianti, perché spesso, sulle loro superfici si può formare il biofilm e da lì i batteri possono raggiungere e infettare altri organi, tramite il circolo sanguigno.
E nel suino? Molti studi hanno dimostrato in vitro, e alcuni anche in vivo, la capacità di formare il biofilm di alcuni agenti patogeni per questa specie. Ad esempio, è stato osservato che Actinobacillus pleuropneumoniae cresce sotto forma di aggregati durante l’infezione naturale e che è in grado di formare un denso biofilm anche su superfici inerti come la plastica o il vetro (Tremblay et al., 2017). In uno studio, circa il 66% degli isolati di Glaesserella parasuis (agente eziologico della malattia di Glasser) hanno dimostrato in vitro la capacità di formare biofilm (Zhang et al., 2014). Escherichia coli estrinseca il proprio meccanismo patogenetico proprio colonizzando la mucosa intestinale (e vescicale) e formando un denso biofilm sulla sua superficie. Inoltre, insieme a Salmonella spp., è un patogeno molto difficile da rimuovere dall’ambiente d’allevamento, perché in grado di colonizzare le superfici in modo molto resistente. Infine, anche per Streptococcus suis è stata dimostrata la capacità di causare la patologia formando un biofilm all’interno dei tessuti di suini infetti (Yi et al., 2023). Purtroppo, non è sempre facile indagare il ruolo del biofilm nel meccanismo patogenetico, ma nuove conoscenze potrebbero essere utili sia per la profilassi che per un trattamento antibiotico più mirato.
Hall-Stoodley, L., & Stoodley, P. (2009). Evolving concepts in biofilm infections. In Cellular Microbiology (Vol. 11, Issue 7, pp. 1034–1043).
Monroe, D. (2007). Looking for chinks in the armor of bacterial biofilms. In PLoS Biology (Vol. 5, Issue 11, pp. 2458–2461).
Tremblay, Y. D. N., Labrie, J., Chénier, S., & Jacques, M. (2017). Actinobacillus pleuropneumoniae grows as aggregates in the lung of pigs: is it time to refine our in vitro biofilm assays? Microbial Biotechnology, 10(4), 756–760.
Yi, L., Fan, Q., Wang, H., Fan, H., Zuo, J., Wang, Y., & Wang, Y. (2023). Establishment of Streptococcus suis Biofilm Infection Model In Vivo and Comparative Analysis of Gene Expression Profiles between In Vivo and In Vitro Biofilms . Microbiology Spectrum, 11(1).
Zhang, J., Xu, C., Shen, H., Li, J., Guo, L., Cao, G., Feng, S., & Liao, M. (2014). Biofilm formation in Haemophilus parasuis: Relationship with antibiotic resistance, serotype and genetic typing. Research in Veterinary Science, 97(2), 171–175.